√ Teladan Soal Dan Pembahasan Asam Basa Dan Titrasi
Contoh Soal dan Pembahasan Asam Basa dan Titrasi
style="display:block"
Baca Juga
data-ad-slot="5411244982"
data-ad-format="link"
data-full-width-responsive="true">
PEMBAHASAN :
Dengan memakai suatu alat yang sanggup membedakan mana asam atau basa yang disebut indikator
DOWNLOAD CONTOH SOAL ASAM BASA DALAM BENTUK PDF KLIK DISINI
style="display:block; text-align:center;"
data-ad-layout="in-article"
data-ad-format="fluid"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="8126346735">
B. Jelaskan persyaratan suatu zat sanggup dipakai sebagai indikator asam-basa
PEMBAHASAN :
A. suatu materi atau alat yang sanggup memilih sifat asam / basa suatu larutan
B. persyaratan suatu zat sanggup dipakai sebagai indikator yaitu mempunyai warna yang berbeda ketika dimasukan ke dalam larutan asam atau ke larutan basa
LIHAT JUGA : Rangkuman Materi Asam Basa
PEMBAHASAN :
Kembang sepatu
Kol ungu
Kunyit
Daun pandan
Bunga kertas
LIHAT JUGA : Video Pembelajaran Asam Basa
PEMBAHASAN :
Asam : Zat yang dimasukan ke dalam air akan menghasilkan ion H+
Contoh :
Asam
HCl → H+ + Cl–
Basa
NaOH → Na+ + OH–
Basa : Zat yang dimasukan ke dalam air akan menghasilkan ion OH–
a. CH3COOH(aq) →
b. H2CO3(aq) →
c. HNO3(aq) →
d. NH4OH(aq) →
e. Ca(OH)2 →
PEMBAHASAN :
a. CH3COOH(aq) → CH3COO–(aq) + H+(aq)
b. H2CO3(aq) → 2H+(aq) + CO32-(aq)
c. HNO3(aq) → H+(aq) + NO3(aq)
d. NH4OH(aq) → NH4+(aq) + OH–(aq)
e. Ca(OH)2 → Ca2+(aq) + 2OH–(aq)
PEMBAHASAN :
Asam lemah : asam yang derajat ionisasinya lebih kecil dibanding asam besar lengan berkuasa atau kurang terurai dan sedikit menghasilkan ion H+ dalam larutannya
Asam besar lengan berkuasa : asam yang derajat ionisasinya besar atau gampang terurai dan banyak menghasilkan ion H+ dalam larutannya
style="display:block; text-align:center;"
data-ad-layout="in-article"
data-ad-format="fluid"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="8126346735">
PEMBAHASAN :
Asam : pemberi/donor proton (H+)
Basa : penerima/akseptor proton (H+)
Tentukan spesi yang bertindak sebagai asam dan basa dan pasangan asam-basa konjugasinya
a. H2O(l) + NH3(aq) ⇔ NH4+ (aq) + OH‑(aq)
b. H2PO4– (aq) + H2O(l) ⇔ H3PO4(aq) + OH–(aq)
c. HPO42- (aq) + H2O(l) ⇔ PO43-(aq) + H3O+(aq)
d. HCN (aq) + H2O(aq) ⇔ CN–(aq) + H3O+(aq)
e. NH3(l) + NH3(l) ⇔ NH4+(l) + NH2–(l)
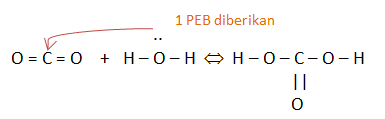
PEMBAHASAN :
Asam : Penerima/akseptor pasangan elektron
Basa : Pemberi/donor pasangan elektron
Contoh:
NH3 + BF3 → NH3BF3
Basa asam
NH3 memberikan pasangan elektron bebasnya ke BF3 yang tidak oktet
PEMBAHASAN :
Kelebihan Arrhenius : bisa menjelaskan proses netralisasi lebih baik dibanding teori-teori sebelumnya
Kelebihan Brosted-Lowry : Dapat menjelaskan basa yang tidak mempunyai ion OH– dan tidak terbatas pada pereaksi air.
Kelebihan Lewis : Dapat menjelaskan asam yang tidak mempunyai ion H+, sanggup menjelaskan asam basa tanpa ada H+ dan OH–
a. CH3COOH
b. NaOH
PEMBAHASAN :
a. CH3COOH = bersifat asam. Basa konjugasinya yaitu CH3COO–
b. NaOH = bersifat basa. Asam konjugasinya yaitu Na+
style="display:block; text-align:center;"
data-ad-layout="in-article"
data-ad-format="fluid"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="8126346735">
PEMBAHASAN :
Bersifat asam dengan melepaskan 1H+
H2PO4– → HPO42-
Bersifat basa dengan mendapatkan 1 H+
H2PO4– → PO42-
HCO3–(aq) + H2O(l) ⇔ CO32-(aq) + H3O+(aq)
HCO3–(aq) + H2O(l) ⇔ H2CO3(aq) + OH–(aq)
Tentukan pasangan asam-basa konjugasi pada reaksi di atas
CO2(g) + H2O(l) ⇔ H2CO3(aq)
Gambarkan struktur Lewis dari reaksi tersebut. Jelaskan manakah molekul yang bertindak sebagai asam dan sebagai basa
Yang bertindak sebagai asam yaitu CO2 alasannya yaitu mendapatkan pasangan elektron sedangkan yang bertindak sebagai basa yaitu H2O alasannya yaitu menunjukkan 1 pasangan elektron
PEMBAHASAN :
Tidak bisa menjelaskan reaksi asam basa yang tidak melibatkan proton (H+)
PEMBAHASAN :
Kw = [H+].[OH–]
10-12 = [H+].[OH–]
Reaksi swaionisasi air
H2O ⇔ H+ + OH–
Karena koefisiennya sama maka, [H+] = [OH–]
10-12 = [H+].[H+]
10-12 = [H+]2
[H+] =
Maka [OH–] = 10-6 M
a. Larutan H2SO4 0,1 M
b. 100 mL larutan Ba(OH)2 5 x 10-4 M
c. Larutan HBrO 0,1 M Ka = 4 x 10-9
d. Larutan NH3 0,1 M Kb = 10-5

Tentukan:
a. Asam yang paling besar lengan berkuasa dan yang paling lemah
b. Urutan kekuatan asam dari yang paling lemah ke yang paling kuat
PEMBAHASAN :
- Rumusan [H+] untuk asam lemah yaitu [H+] = , dimana nilai Ka berbanding lurus dengan [H+], semakin besar Ka maka [H+] semakin besar artinya semakin besar lengan berkuasa asamnya begitu pula sebaliknya. Makara untuk memilih mana yang paling besar lengan berkuasa berarti Ka yang paling besar yaitu HIO3 (Ka = 1,6 x 10-1). Sedangkan yang paling lemah berarti nilai Ka nya kecil yaitu HbrO (Ka = 2,3 x 10-9)
- Asam dari yang paling lemah ke yang paling besar lengan berkuasa (Ka kecil ke Ka besar)
HBrO – C6H5COOH – HF – HClO2 – HIO3
a. Ba(OH)2 0,0005 M
b. HCl 0,02 M
c. CH3COOH 0,1 M (Ka = 10-5)
d. NH3 0,1 M (Kb = 10-5)
e. HF 0,1 M (Ka = 8,1 x 10-4)
PEMBAHASAN :
Misal :
Volume HCl = v mL
Volume H2SO4 = v mL
maka nH+total = nH+1 + nH+2
nH+1 dari HCl
nH+1 = a . Ma. V = 1 x 10-1 . V = 10-1 V
nH+2 dari H2SO4
nH+2 = a . Ma.V = 2 x 10-1 V
nH+total = nH+1 + nH+2 = 0,1V + 0,2V = 0,3V
[H+] = n/V total = 0,3 V/ (V +V) = 0,3/2 = 0,15 = 1,5 x 10-1
pH = 1 – log 1,5
PEMBAHASAN :
Agar warna larutan berwarna HIn maka pH larutan harus lebih kecil dari pKa dan kalau ingin berwarna In– maka pH larutan harus lebih besar dari pKa. Jika Ka = 10-5 maka pKa nya = 5. Untuk berwarna merah (HIn) maka pHnya harus lebih kecil dari 5 (pH < 5). Sedangkan untuk berwarna kuning (In–) maka pHnya harus lebih besar dari 5 (pH > 5)
PEMBAHASAN :
Jika menghasilkan warna yang sama maka pH kedua larutan sama, artinya [H+] nya sama
PEMBAHASAN :
Dengan penambahan Metil merah = Jingga artinya pHnya diantara 4,4 – 6,2 (perpaduan warna)
Dengan penambahan metil jingga = kuning, artinya pHnya > 4,4
Jika dibuat diagramnya
pH berada pada rentang : 4,4 < pH < 6,2
Jika ditambah BTB maka akan ada dua kemungkinan:
Jika pHnya < 6 maka berwarna kuning
Jika pHnya 6 < pH < 6,2 maka warnanya akan hijau
a. CH3COOH 0,1 M (Ka = 10-5)
b. NaOH 0,01 M
c. Air murni
- Apa warna larutan CH3COOH 0,1 M ( Ka = 10-5) kalau ditetesi ketiga indikator di atas?
- Jika suatu larutan berwarna hijau dengan penambahan BTB. Apa larutan tersebut kalau ditambah PP
- Jika suatu larutan ditambah metil jingga berwarna merah, apa warna larutan kalau ditetesi bromtimol biru?
PEMBAHASAN :
pH sebelum dicampur
pH H2SO4 (asam kuat)
[H+] = a. Ma = 2 . 10-1 M
pH = 1 – log 2
pH KOH (basa kuat)
[OH–] = b. Mb = 1 . 10-1 M
pOH = 1, pH = 14 – 1 = 13
PH sehabis dicampur
n H2SO4 = M x V = 0,1M x 100 ml = 10 mmol
n KOH = M x V = 0,1M x 100 ml = 10 mmol
PEMBAHASAN :
[H+] dari larutan dengan pH = 1 yaitu 10-1 M
[OH–] dari larutan dengan pH = 13 atau pOH = 14 -13 = 1 yaitu 10-1 M
Reaksikan H+ dengan OH–
nH+ = M x V = 10-1 x 100 ml = 10 mmol
nOH– = M x V = 10-1 x 50 ml = 5 mmol
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma. Va = b. Mb. Vb
2.0,5M. 50 ml = 1. 1 M. Vb
Vb = 50 ml
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va = b. Mb.Vb
1. Ma. 5 mL = 2 . 0,001 M. 20 mL
Ma = 0,04/5 = 0,008 M
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va = b.Mb. Vb
1.0,05 M. 10 mL = 2. Mol basa
Mol b = 0,25 mmol
Gr = mol x Mr = 0,25 mmol x 74 = 18,5 mgram = 0,0185 gram
PEMBAHASAN :
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va =b.Mb.Vb
2.0,1 M. 10 mL = 1. Mb. 50 mL
Mb = 2/50 = 0,04 M
PEMBAHASAN :
Menggunakan rumus netralisasi
a.Ma.Va =b.Mb.Vb
2. 0,3 M. 25 cm3 = 1. 0,1 M. Vb
Vb = 15/0,1 = 150 cm3
Reaksi yang terjadi:
Mol NaOH = M x V = 0,3 M . x cm3 = 0,3x mmol
Mol MgCl2 = M x V = 0,2 M . 75 cm3 = 15 mmol
Agar sempurna habis bereaksi maka NaOH & MgCl2 harus habis
Mula2 0,3 x 15 – –
Reaksi 0,3x 0,15x – 0,15x 0,3x +
Sisa – 15 – 0,15x 0,15x 0,3x
15 – 0,15x = 0 (habis bereaksi)
15 = 0,15x
x =15/0,15 =100 cm3 (volume NaOH)
Menentukan gram Mg(OH)2
n Mg(OH)2 = 0,15x = 0,15.100 = 15 mmol = 0,015 mol
Gr = n x Mr = 0,015 mol x 58 = 0,87 gram
PEMBAHASAN
Menggunakan rumus titrasi
a.Ma.Va = b.Mb.Vb
0,1 M. 25 mL = 1. Mb. 29 mL
Mb = 2,5/ 29 = 0,086 M
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
DOWNLOAD CONTOH SOAL ASAM BASA DALAM BENTUK PDF KLIK DISINI
style="display:block"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="5411244982"
data-ad-format="link"
data-full-width-responsive="true">
Sumber aciknadzirah.blogspot.com

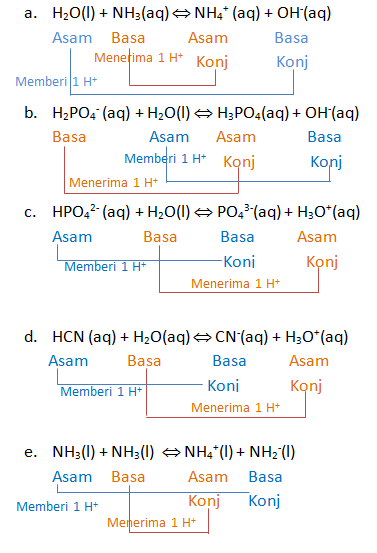


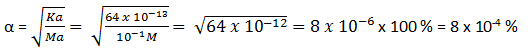

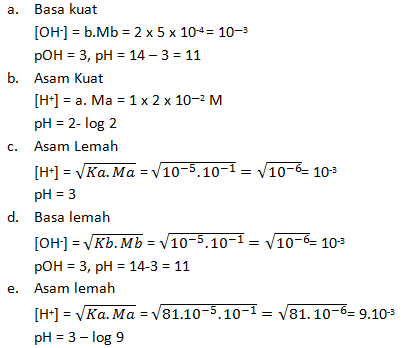
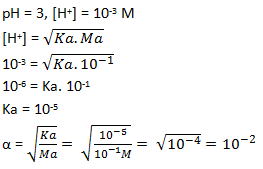
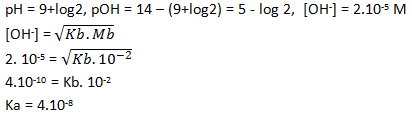

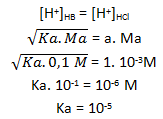









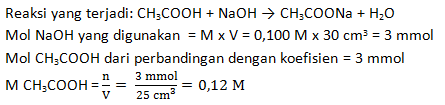


0 Response to "√ Teladan Soal Dan Pembahasan Asam Basa Dan Titrasi"
Posting Komentar